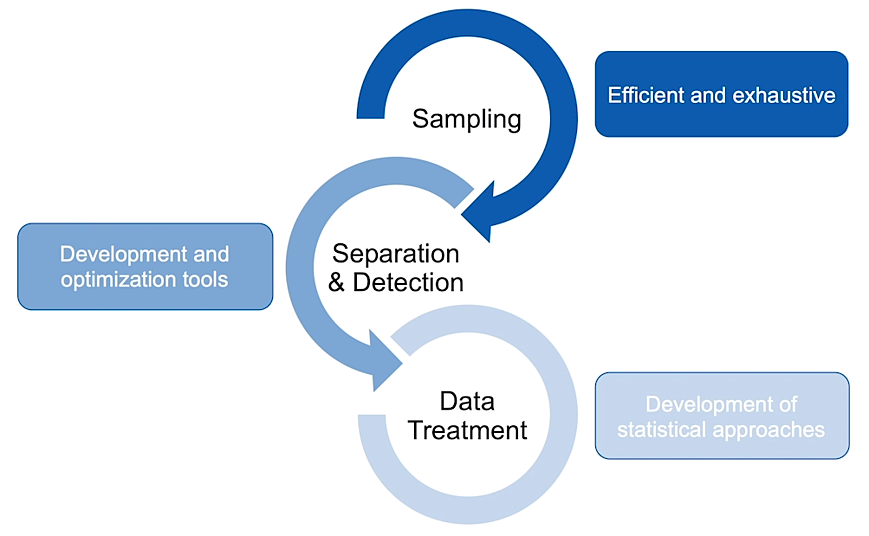
W przypadku każdego projektu klinicznego prowadzonego przez grupę Jefa istnieją trzy „filary” projektu. Najpierw należy pobrać próbki. Następnie próbki trzeba przepuścić przez spektrometr mas w celu separacji i detekcji. Wreszcie uzyskane dane trzeba odpowiednio przetworzyć, aby uzyskać użyteczne i czytelne wyniki. O ile kiedyś przetwarzanie danych było najmniejszym filarem, postępy w technologiach firmy LECO oznaczają, że powstaje tak wiele danych, że niezbędne stało się ich rozrzedzenie i uproszczenie.
„Ponieważ kiedy idziemy do szpitala i rozmawiamy ze współpracownikami, nie obchodzi ich to, kiedy zaczynam mówić: „Och, okres modulacji wynosił 4 sekundy, szybkość akwizycji wynosiła 250 herców…”. Mówią „Tak, tak”, bo są uprzejmi, ale po prostu mają to gdzieś. Chcą tylko wiedzieć: czy próbka jest dodatnia, czy ujemna”.
W przypadku opieki nad pacjentem minimalizacja fałszywych wyników ujemnych lub fałszywych wyników dodatnich ma kluczowe znaczenie dla zapewnienia właściwego leczenia. Każdy z trzech filarów odgrywa kluczową rolę w tym procesie.
Wszystkie wyniki zaczynają się od pobrania próbki. Istnieje wiele sposobów pobierania próbek od pacjenta z astmą, ale wiele z nich uważa się za procedury „inwazyjne”, na przykład pobieranie krwi lub plwociny, płukanie oskrzelowo-płucne, biopsja szczoteczkowa nabłonka oskrzeli i biopsja ścian oskrzeli. Natomiast zbieranie kondensatu powietrza wydychanego w worku Tedlar® jest stosunkowo szybką i bezbolesną metodą pozyskania próbki od pacjenta. Ponadto łatwo jest wyjaśnić pacjentowi: Oto worek, proszę dmuchnąć do środka.
Po pobraniu próbki i przekazaniu jej do laboratorium spektrometr Pegasus LECO® BT 4D może odseparować i wykryć setki tysięcy związków w próbce. Jef mówi, że w tym miejscu wiele osób się myli.
„Musisz mieć pewność, że możesz skorzystać z dobrych danych. Znowu jest to wada systemu GC×GC i TOFMS, ponieważ instrumenty są na tyle dobre, że może się skończyć niską wydajnością modulacji, złym kształtem wartości szczytowych, a mimo to system dostarczy pewnych informacji. Jednak systemowi trudniej będzie przekazać dobre informacje. Tak więc posiadanie dobrego kształtu wartości szczytowych, dobrej intensywności wartości szczytowych oraz dobrej separacji jest zawsze bardzo ważne”.
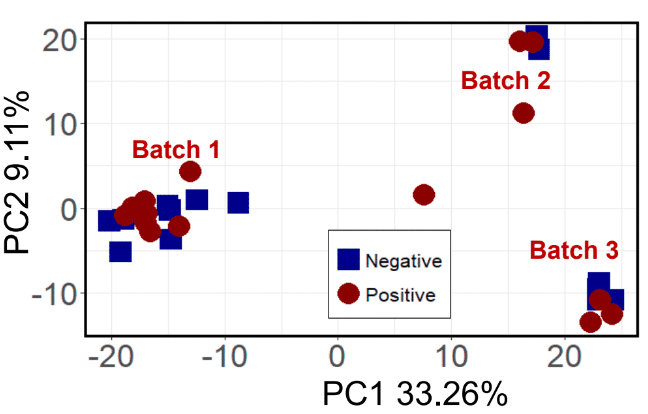
Po przetworzeniu danych można zastosować zabiegi statystyczne. Przed badaniem pacjentów z astmą grupa Jefa przeprowadziła najpierw pewne eksperymenty z udziałem grupy testowej pacjentów z rakiem płuc i grupy kontrolnej. Badacze chcieli najpierw ustalić, czy można w ogóle wykorzystać kondensat powietrza wydychanego, aby określić zdrowie pacjenta. Pierwsze zabiegi przetwarzania danych spowodowały pewną separację między grupami, ale skończyły się trzema odrębnymi grupami zamiast dwóch. Udało im się ustalić, że środowiskowe LZO zostały wykryte pośród rakowych LZO, a te trzy grupy były w rzeczywistości trzema różnymi porami roku, w których pobrano próbki. Choć odkrycie było fascynujące, nie był to zamierzony rezultat.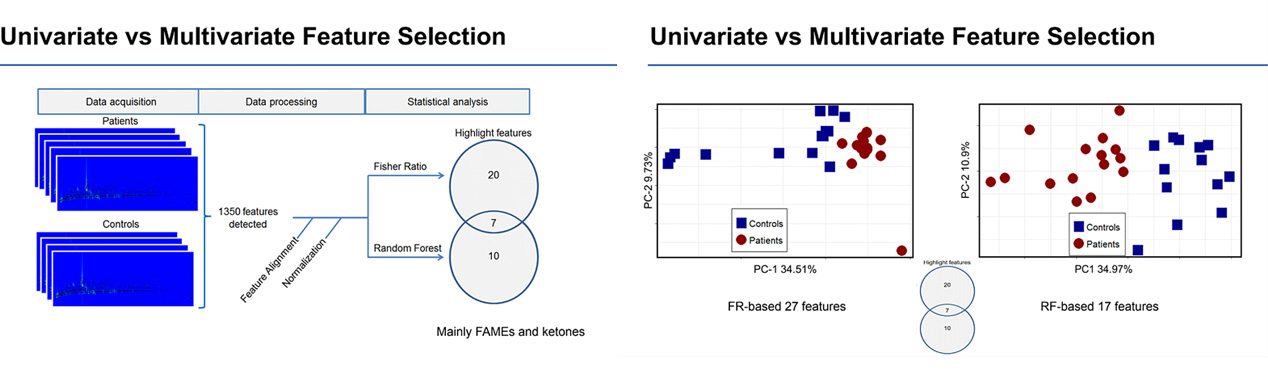
Korzystając z różnych metod klasyfikacji, Jef był w stanie zawęzić 1350 wykrytych cech do dwóch zestawów: 27 z współczynnikiem Fishera i 17 z lasem losowym, z których 7 się pokrywało. Dalej był w stanie podzielić próbki na dwie odrębne grupy, dodatnie dla raka płuc i ujemne dla raka płuc.
Dzięki zastosowaniu próbek do spektrometru Pegasus® GC-HRT 4D o wysokiej rozdzielczości Jef mógł dalej rozdzielać związki, których używał jako markerów.
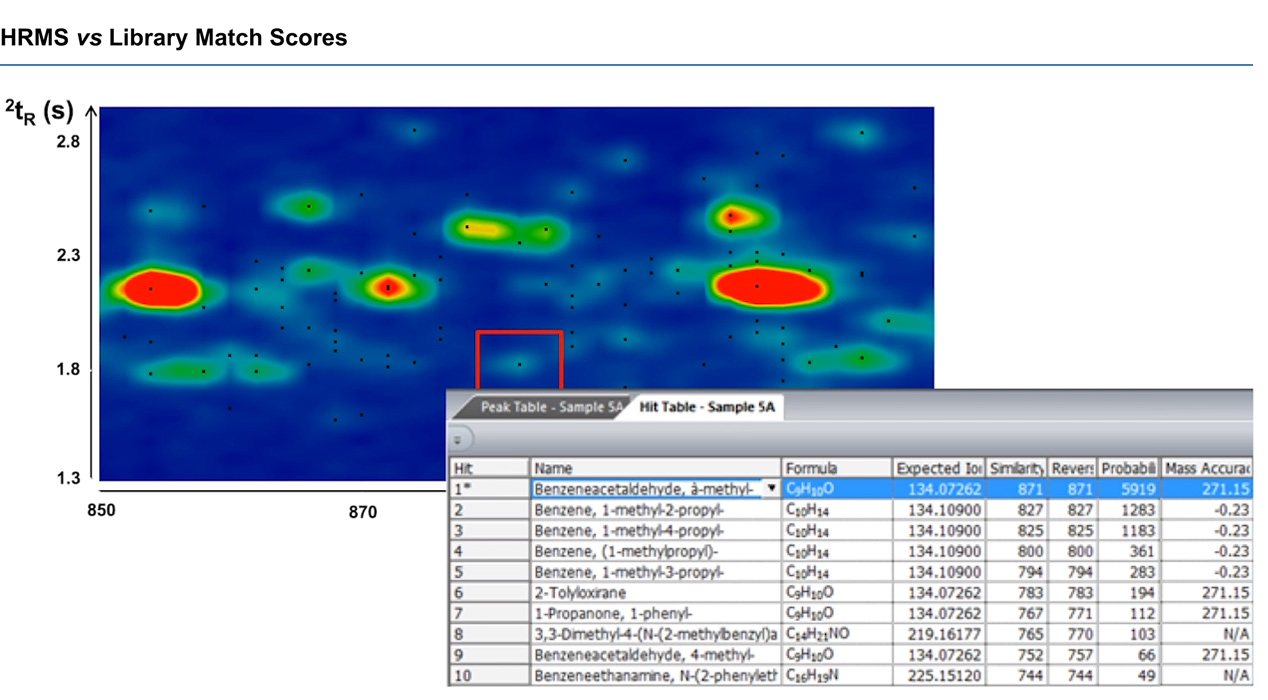
Jak pokazano powyżej, zaznaczona wartość szczytowa początkowo wygląda jak benzenoacetaldehyd, z wynikiem dopasowania biblioteki 871. Jednak spektrometria mas w wysokiej rozdzielczości pozwoliła Jefowi zobaczyć, że dokładność masy była niewiarygodnie niska — 271,15 ppm, podczas gdy następny prawdopodobny wynik, benzen, z podobieństwem na poziomie 827, miał znacznie lepszą dokładność masy -0,23 ppm. Dzięki zastosowaniu obu instrumentów w tandemie Jef był w stanie uzyskać z danych znacznie lepsze informacje chemiczne.
Po tych doświadczeniach Jef przeprowadził badanie nad śladem oddechowym astmy. Wzrost liczby przypadków o 200% w ciągu ostatnich dziesięciu lat sprawił, że astma dotyka ponad 334 milionów ludzi na całym świecie i 14% dzieci w wieku poniżej 18 lat. Jest to rosnący problem, a jednak 20% pacjentów chorych na astmę przepisuje się niewłaściwy lek.
Istnieją dwa główne fenotypy astmy: obojętnochłonny i eozynochłonny. Astma obojętnochłonna jest wywoływana bardziej przez zanieczyszczenia oraz infekcje i może być leczona antybiotykami, podczas gdy astma eozynochłonna jest wywoływana przez alergeny i leczona kortykosteroidami. Kortykosteroidy nie działają na astmę obojętnochłonną, a antybiotyki na astmę eozynochłonną.
Jak wspomniano wcześniej, wiele metod diagnozowania astmy jest inwazyjnych i ma wskaźnik dokładności na poziomie 67–72%. Grupa Jefa podjęła wyzwanie pobierania kondensatów oddechowych od pacjentów z astmą, aby sprawdzić, czy technologia GC×GC-TOFMS może postawić bardziej realną diagnozę. Aby dowiedzieć się o jego wynikach, sprawdź tutaj jego nagranie z porannego seminarium z tegorocznego posiedzenia ASMS w całości.
* Ten produkt nie jest przeznaczony do diagnozowania, leczenia ani zapobiegania jakiejkolwiek chorobie.